Dobell C (1960) Antony van Leeuwenhoek and his Little Animals. New York: Dover Publications.
Fire A, Montgomery MK, Kostas SA, Driver SE, Mello CC (1998) Potent and specific genetic interference by doublestranded
RNA in Caenorhabditis elegans. Nature 391, 806–11.
Häusler Th, Kühne Chr (2022) Batkteriophagen - Wenn Antibiotika nicht mehr helfen -
mit Viren gegen multiresistente Keime.
www.suedwest-verlag.deHuebscher W, Barbakow F, Peters OA (2003) Root canal preparation with FlexMaster: canal shapes analysed by
micro-computed tomography. International Endodontic Journal 36, 740–7.
Kakehashi S, Stanley HR, Fitzgerald RJ (1965) The effects of surgical exposures of dental pulps in germ-free and conventional
laboratory rats. Oral Surgery Oral Medicine and Oral Pathology 20, 340–9.
Komiyama M (2013) Cut and paste of DNA using an artificial restriction DNA cutter. International Journal of Molecular
Sciences 14, 3343–57.
Lin LM, Ricucci D, Huang GTJ (2013) Regeneration of the dentine-pulp complex with revitalization/revascularization
therapy: challenges and hopes. International Endodontic Journal. Accepted article. doi:10.1111/iej.12210.
Lin LM, Schimizu E, Gibbs JL, Logbin S, Riccuci D (2014) Histologic and histobacteriologic observation of failed
revascularization/revitalization therapy: a case report. Journal of Endodontics 40, 291–5.
Miller WD (1894) An introduction to the study of bacteriopathology of the dental pulp. Dental Cosmos 36, 505–27.
Nair PNR (1987) Light and electron microscopic studies of root canal flora and periapical lesions.
Journal of Endodontics 13, 29–39.
Nair PNR, Sjogren U, Kahnberg KE, Krey G, Sundqvist G (1990) Intraradicular bacteria and fungi in root-filled,
asymptomatic human teeth with therapy-resistant periapical lesions: a long-term light and electron microscopic follow-up study.
Journal of Endodontics 16, 580–8.
Nair PNR (1997) Apical periodontitis: a dynamic encounter between root canal infection and host response.
Periodontology 2000 13, 121–48.
Nair PNR, Henry S, Cano V, Vera J (2005) Microbial status of apical root canal system of human mandibular first
molars with primary apical periodontitis after ‘one-visit’ endodontic treatment.
Oral Surgery Oral Medicine Oral Pathology Oral Radiology and Endodontics 99, 231–52.
Nair PNR, Schroeder HE (1984) Periapical actinomycosis. Journal of Endodontics 10, 567–70.
Nair PNR (2006) On the causes of persistent apical periodontitis: a review.
International Endodontic Journal 39, 249–81.
Peters OA, Schonenberger K, Laib A (2001) Effects of four Ni–Ti preparation techniques on root canal geometry assessed by
micro computed tomography. International Endodontic Journal 34, 221–30.
Peters OA, Peters CI, Schonenberger K, Barbakow F (2003) ProTaper rotary root canal preparation: effects of canal
anatomy on final shape analysed by micro CT. International Endodontic Journal 36, 86–92.
Rostetter C, Schenkel J, Rücker M, Lübbers HT (2017) Amoxicillin mit Clavulansäure –
Standardantibiotikum im allgemeinzahnärztlichen Alltag. SWISS DENTAL JOURNAL SSO 127, 654-5.
Sundqvist G (1976) Bacteriological studies of necrotic dental pulps (Dr. Odont. Thesis).
Umeå, Sweden: University of Umeå.
Sundqvist G, Figdor D (2003) Life as an endodontic pathogen: ecological differences between the untreated and
root-filled root canals. Endodontic Topics 6, 3–28.
Tachibana M, Amato P, Sparman M et al. (2013) Human embryonic stem cells derived by somatic cell nuclear transfer.
Cell 153, 1228–38.
Takahashi K, Yamanaka S (2006) Induction of pluripotent stem cells from mouse embryonic and adult fibroblast
cultures by defined factors. Cell 126, 663–76.
Volponi AA, Kawasaki M, Sharpe PT (2013) Adult gingival epithelial cells as a source for whole-tooth bioengineering.
Journal of Dental Research 92, 329–34.

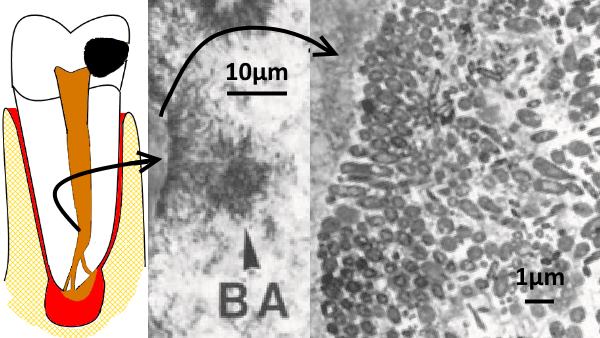
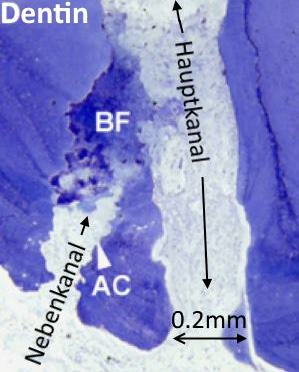 Abb. 2)
Abb. 2)  Abb. 3)
Abb. 3) 

