
Dr. med. dent.
Walter Weilenmann
eidg. dipl. Zahnarzt
dipl. Natw. ETH
Mitglied SSO, SSGS
und SSO-Zürich.
Walter Weilenmann
eidg. dipl. Zahnarzt
dipl. Natw. ETH
Mitglied SSO, SSGS
und SSO-Zürich.
- Home
- Praxis/Preise
- Leistung
- Gegen Knirschen + Pressen
- Reizarme Zahnbehandlungen
- Wurzelbehandlungen
- Komposit und ...-------
- ... BISSERHÖHUNG
- ... Ersatz für Kronen
- ... Gespaltene Zähne
- ... Implantate
- ... Kleine Orthodontie
- ... Kompositbrücken
- ... Komposit-Stiftaufbauten
- ... Milchzähne
- ... Prothesen
- ... Reparaturen
- ... Schönheit
- ... Zahnhalsfüllungen
- Login/Termin
- Kunst
- Artho Roland
- Barg Silke
- Bhend Emma
- Biank Andreas
- Börlin Hans
- Dahinden Cécile
- Duó-Meyer Sonja
- Friedauer Brent
- Issaka Luzia
- Dr. Kellermann Klaus M.
- Kuster-Pollo Cynthia
- Müller Claire
- Nora von Allmen
- Peissard Gret
- Ruckstuhl Erwin
- Ruckstuhl Michael
- Soldati Barbara
- Vogt Monika
- Wahl Hans Peter
- Weber Paul
- Weilenmann−Studerus H.
- Wernicke Karl Ernst
- Prof. Wirz Jakob
- Yüksel Ceylin
- Wissenschaft
- Publikationen und Vorträge
- Rätsel im Mund
- 20 Jahre Tetric
- Akute Schmerzen
- Bimanuelle Haltetechnik
- Frakturlehre
- Frakturen bei Amalgam
- Frakturen bei Komposit
- Frakturen bei Wurzelfüllungen
- DIE PULPA +
- Freies Modellieren
- Kaureflex
- Komposit nach Frakturen
- Kompositbrücken
- Mandibularanästhesie
- --- MECHANIK der Zähne ---
- Minibrücken
- Minimatrizen
- Reizarme Zahnbehandlungen
- Restkaries
- Strukturbiologie des Zahnes
- Versprödung des Zahnes
- Zahnbürsten
- Zahnstellung
- Selbsthilfe
- Spiele
- Nachdenken
- Alterszahnmedizin
- Angst beim Zahnarzt
- Ausserordentliche Erlebnisse
- Bakterien und Viren im Mund
- Biologische Betrachtungen
- Bruxismus und Phantombiss
- Ein ruhiger Arbeitstag
- Evolution der Zähne
- Formenvielfalt der Kauflächen
- Gefühle
- Graphologie und Handwerkskunst
- Grenzen der Schönheit
- Gute Zahnmedizin
- Gute Zähne im Alter
- Humoristisches Praxis-Wörterbuch
- Löcher zum Abwarten
- MIT oder OHNE Spritze?
- Ratlose Zahnärzte
- Spezialisierung auf Komposit
- Überforderung
- Verlorene Zähne
- Was ist Amalgam?
- Was ist Komposit?
- Wie gross ist die Röntgenbelastung?
- Wundheilung
- Wurzelbehandlungen sind kritisch
- Zähne und Verhalten
- Zukunft der Zahnmedizin
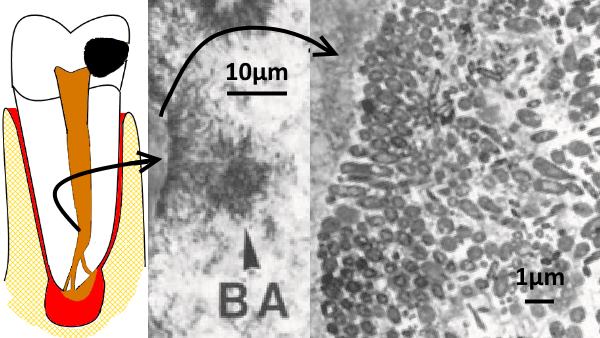
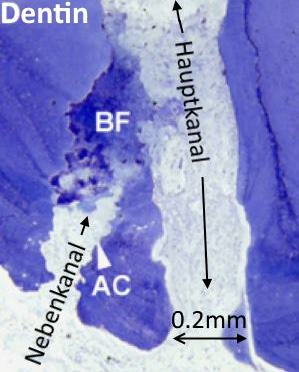 Abb. 2)
Abb. 2)  Abb. 3)
Abb. 3) 

